Болезнь Пейрони (фибропластическая индурация) представляет собой редкой заболевание, характеризующееся искривлением полового члена из-за развивающихся фиброзных изменений в его белочной оболочке. Склеротические очаги уплотнения появляются в кавернозных телах. Чаще всего от данного заболевания страдают мужчины в возрасте от 25 и до 60 лет. Средняя частота не превышает одного случая из тысячи.
Несмотря на то, что это заболевание выявлено еще в 1743 году, медики не выявили однозначных причин появления данной патологии. Тем не менее, среди наиболее частых патогенных факторов можно отметить:
- хронические вирусные заболевания (герпес);
- травмы кавернозных тел;
- нарушения микроциркуляции крови;
- иммунные конфликты;
- системные заболевания соединительной ткани.
Также косвенной причиной возникновения болезни Пейрони может быть фимоз или сужение крайней плоти.
В большинстве случаев пациенты обращаются к урологу на поздних стадиях развития заболевания. Когда искривление полового члена в состоянии эрекции становится явным и причиняет неудобства при половом акте. Иногда течение болезни сопровождается незначительными болезненными ощущениями.
В процессе обследования уролог обнаруживает плотные фиброзные бляшки, локализирующиеся на боковых поверхностях и спинке полового члена. В очагах индурации довольно часто (в 30% случаев) откладываются кальциевые соли, что придает им высокую плотность, сходную с костной. Для подтверждения заболевания проводится УЗИ, компьютерно-резонансное или магнитно-резонансное исследование. Для исключения опухолей осуществляется биопсия новообразований с последующим гистологическим исследованием.
Лечение болезни Пейрони
В настоящее время для лечения болезни Пейрони с большим успехом применяется метод ударно-волновой терапии. По данным клинических исследований, большинство пациентов, прошедших курс процедур УВТ, сообщают о существенном уменьшении боли, вплоть до полного купирования болевого синдрома, восстановлении эректильной функции, уменьшении размеров бляшки и степени искривления полового члена. Все это приводит к повышению качества жизни пациентов.
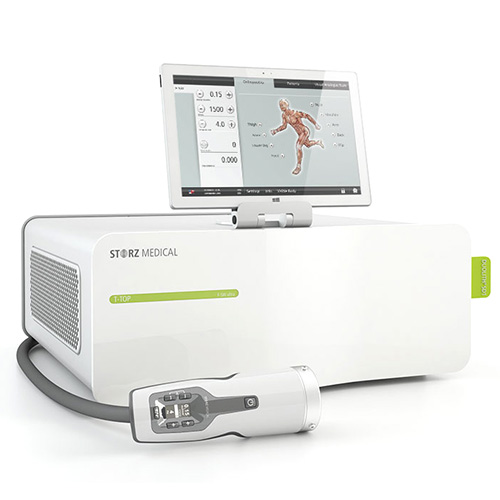
В клинике №1 ВиТерра Беляево процедуры УВТ проводятся на современном аппарате ударно-волновой терапии DUOLITH SD1 T-TOP «F-SW ULTRA» высококвалифицированными врачами урологами-андрологами.