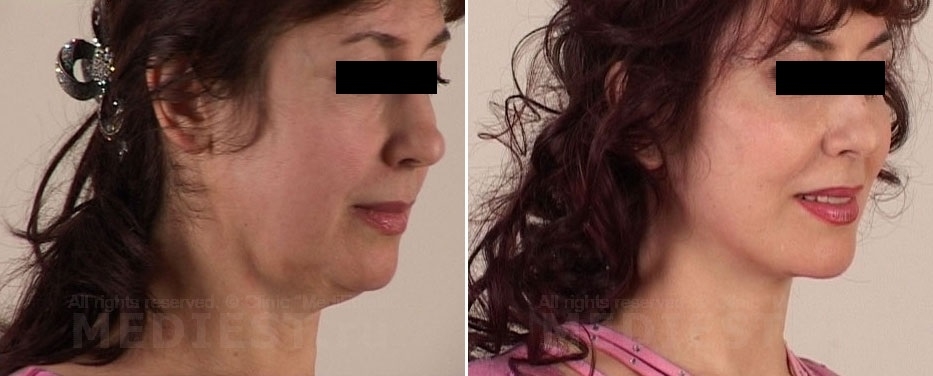
Одобрен новый эффективный препарат для борьбы со вторым подбородком.
Food and Drug Administration, FDA (Американское Управление по контролю над продуктами питания и лекарствами) одобрило к применению новый лекарственный препарат против двойного подбородка под названием Kybella. Инъекции этого вещества «растворяют» жировые клетки в подбородке. Это вещество вводят в область скопления жира под подбородком. Впрочем, Kybella способна уничтожить клетки кожи, если инъекция будет проводиться неправильно. Поэтому инъекции должны проводить только лицензированный дерматолог или пластический хирург.
Лекарство представляет собой разновидность дезоксихолевой кислоты - молекулы, которая встречается в организме человека и используется для уничтожения жира. В ходе одного сеанса пациенты могут получить до 50 инъекций вещества.
Согласно FDA, лечение эффективно для двойных подбородков от "умеренных до тяжелых" случаев.
Данный препарат изготовила Американская биофармацевтическая компания Kythera Biopharmaceuticals.
Два клинических испытания с участием 1022 добровольцев установили безопасность и эффективность препарата Kybella. Наиболее распространенными побочными эффектами были припухлость, кровоподтеки, боль, онемение, покраснение.
Неправильный ввод иглы может привести к повреждению нервов, в частности, используемых для улыбки. FDA специально уточняет, что продукт не разрешается для инъекций в других местах, например на животе.
Чтобы двойной подбородок вернулся к нормальному состоянию, необходимо несколько сеансов: до шести сеансов по пятьдесят инъекций в течение полугода.
Kybella раньше был под названием ATX-101, рассказывает доктор Дерек Джонс, который выступил с презентацией о препарате. "Когда двойной подбородок исчезнет, эффект сохранится надолго." Джонс пояснил, что препарат разрушает мембрану жировых клеток, в результате чего она лопается. То, что остается от жировой клетки, поглощается обратно телом "через нормальные метаболические пути," сказал он.
Double Chin Begone: Kybella, A Fat-Destroying Injectable Drug, Approved By The FDA. Apr 30, 2015